《中华器官移植杂志》2024年第1期发表了蔡俊超为通讯作者的文章《抗体介导排斥反应的精准诊疗》。这篇文章详细探讨了抗体介导排斥反应(AMR)的发生机制、病理学表现、诊断标准以及治疗策略。
文章强调,尽管目前临床上采取了多种AMR的治疗方法,但报道的疗效却极不一致,移植界尚无可供推荐使用的AMR标准化治疗方案。因此,需要通过新的治疗药物、完善的治疗方案和国际合作的大型临床试验来发现并确认疗效良好的AMR治疗方案。同时,新的治疗药物或治疗方案的临床应用必须建立在对AMR病因、发生机制和组织损伤病理特征充分了解的基础之上。
现摘录相关内容以供学习参考。
一、AMR的发生机制
AMR是由供者特异性抗体(DSA)引起的对移植物的缺血性和炎性损伤作用,最终可导致移植物失去其生理学功能。
DSA是指受者接受器官或组织移植后体内产生的针对供者特有的人类白细胞抗原(HLA)或非HLA的抗体。
在实体器官移植中,AMR的发生开始于DSA对移植物血管内皮细胞的原发性损伤。内皮受损后,分别发生2类继发性损伤:一类为血管管腔内的血栓形成及因血栓形成而导致的血管所供组织的缺血性损伤,另一类为血管性的炎症反应及因炎症反应而导致的组织急慢性炎性损伤。
(一)AMR的原发作用(DSA引起的内皮损伤)
根据血流动力学的基本原理,抗体对内皮细胞的损伤,取决于受者血液中DSA和供者移植物血管壁内皮细胞表面供者靶抗原的结合。血流速度越慢,越有利于DSA和靶抗原结合。因此,DSA对内皮细胞的损伤作用总是始发于血流速度最慢的毛细血管。
以移植肾为例,DSA最常见的靶组织是肾小球和肾小管周毛细血管的内皮细胞。当DSA和靶抗原结合后,可分别通过补体依赖的损伤途径或抗体依赖的细胞介导的损伤途径破坏靶细胞。
1.补体依赖的损伤机制
DSA结合靶抗原后,可激活补体,并通过3种补体依赖性途径损伤靶细胞,分别为补体依赖的细胞毒(CDC)作用、补体依赖的细胞介导的细胞毒(CDCC)作用和补体依赖的细胞介导的细胞吞噬(CDCP)作用。其中,能引起补体直接对靶细胞杀伤作用CDC的抗体主要包括IgM和IgG,其中IgM、IgG1、IgG2和IgG3通过经典途径活化补体,IgG4则通过旁路途径活化补体。而CDCC或CDCP则是由补体和补体受体介导的杀伤细胞[自然杀伤(NK)细胞、单核巨噬细胞、中性粒细胞和嗜酸性细胞等]或吞噬细胞(单核巨噬细胞、中性粒细胞、树突状细胞等)对靶细胞进行杀伤或吞噬作用。
2.抗体依赖的细胞介导的损伤机制
除了上述的补体依赖的靶细胞损伤作用途径,DSA还可以通过2种抗体依赖的细胞介导的作用途径损伤靶细胞,分别为抗体依赖的细胞介导的细胞毒(ADCC)和抗体依赖的细胞介导的细胞吞噬(ADCP)作用。
其中,ADCC是指当抗体结合到靶细胞表面抗原后,抗体的Fc段与杀伤细胞(NK细胞、单核巨噬细胞、中性粒细胞和嗜酸性细胞等)表面的Fc受体结合,介导杀伤细胞对靶细胞的杀伤作用;而ADCP是指当抗体结合到靶细胞表面抗原后,抗体的Fc段与吞噬细胞(单核巨噬细胞、中性粒细胞和树突状细胞等)表面的Fc受体结合,介导吞噬细胞对靶细胞的吞噬作用。
需要指出的是,除DSA外,固有免疫因素、细胞免疫因素、少数自身抗体、缺血再灌注、病毒感染和某些治疗药物,也同样可以损伤内皮细胞,引起继发性的血管腔内、血管管壁和周围组织的病理改变。
(二)内皮细胞损伤后,发生在血管管腔内的继发性病理改变(血栓形成)
毛细血管内皮细胞受损后,内皮下基底膜暴露、激活血小板、血液凝固性增加,在管腔内形成血栓,这就是急性活动性AMR病理诊断标准中所指的“急性血栓性微血管病”。
这种始发于微小血管的,管腔内的血栓形成、血流受阻,不仅可以导致所供给组织的缺血缺氧性损伤,而且可以进一步累及管径更大的血管,从而引起更大范围的组织缺血缺氧性损伤。急性肾小管损伤(ATI)就是一种最常见的因血栓性血管病变造成的因缺血缺氧而引起的血管外效应。
(三)内皮细胞损伤后,发生在血管管壁及周围组织的继发性病理改变(急慢性血管性炎症反应)
活动性AMR的血管管壁及周围的病理改变,是一种以血管反应为中心环节的急性炎症反应,如肾小球炎、管周毛细血管炎等微血管的炎症反应,以及动脉内膜炎、透壁性动脉炎等管径更大的血管的急性炎症反应;如果这种急性期的血管性炎症反应持续存在,就会演变为慢性炎症反应,引起对移植物血管内皮细胞及内皮下结缔组织的长期慢性损伤,从而呈现出血管炎症性损伤后的、以组织修复为主要特征的形态学表现:如肾小球基底膜和管周毛细血管基底膜的复层、动脉内膜纤维化。
慢性活动性AMR的病理改变可以从有明显表现的活动性AMR的长期迁延不愈发展而来,也可以从无明显表现的活动性AMR由量变到质变地对移植物的隐匿性损伤的累积效应发展而来。可能的发生机制是,当血管内皮细胞及内皮下基底膜在DSA作用下受损后,其修复过程依赖于内皮细胞受损后的间充质化,成为成纤维细胞或内皮下基底膜等结缔组织中的固有成纤维细胞与其分泌合成的细胞外基质间的相互作用。成纤维细胞的增殖,合成并分泌大量细胞外基质以填补组织间缺损;组织损伤的迁延不愈,导致成纤维细胞的过度增殖和分泌,引起细胞外基质的异常沉积,从而导致慢性AMR病理变化中常见的肾小球基底膜和管周毛细血管基底膜出现复层、动脉内膜发生纤维化改变。
需要指出的是,在AMR中出现的急慢性血管性炎症反应的表现,与固有免疫因素、细胞免疫因素、少数自身抗体、缺血再灌注、病毒感染及某些治疗药物等引起的内皮破坏后的急慢性血管性炎症反应基本一致。
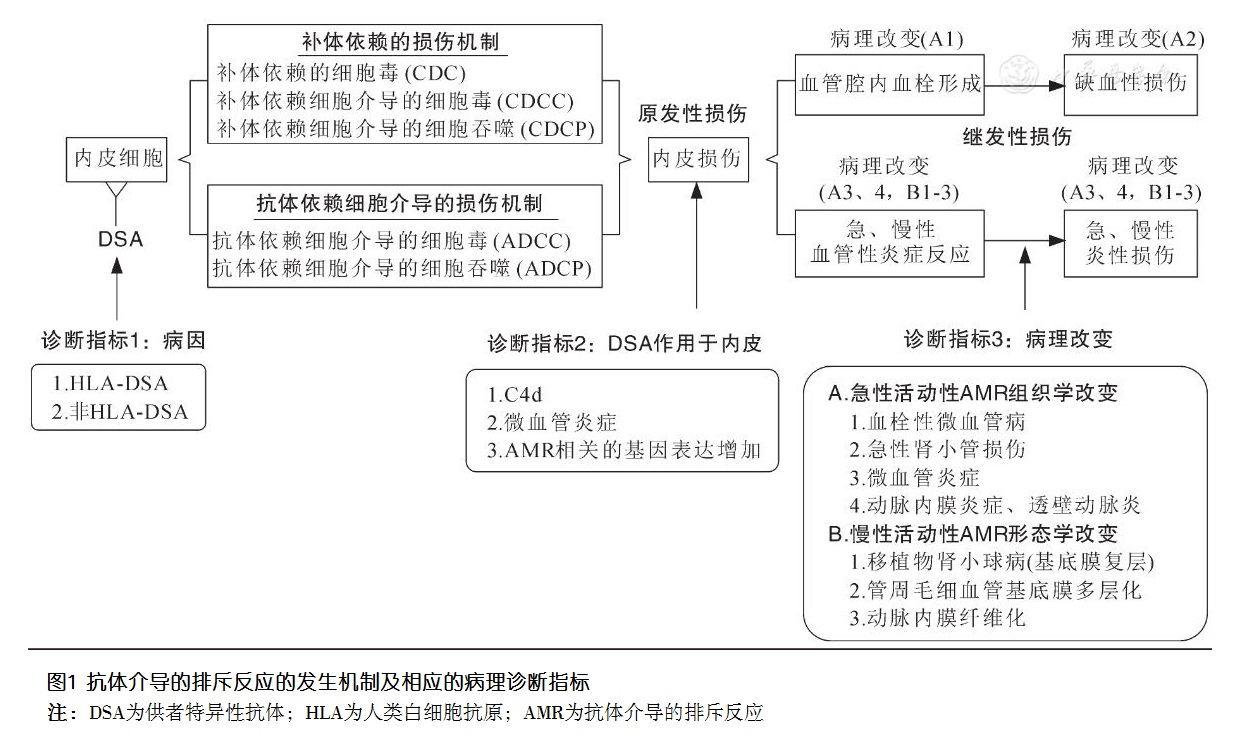
二、AMR的Banff国际诊断标准
Banff国际诊断标准在确诊活动性AMR时,需要满足3个必要条件:
①病因为HLA-DSA或非HLA-DSA;
②DSA于内皮的证据(C4d沉着、微血管炎症反应、与AMR相关的转录或分类因子基因的表达水平改变等);
③急性活动性AMR组织损伤的组织学改变证据和慢性活动性AMR组织损伤的形态学改变证据。
三、AMR的预防和治疗措施
肾移植的Banff国际诊断标准中,确诊急性活动性AMR的3个必要条件分别说明了AMR的原发病因、病因导致的原发性内皮损伤及在原发性内皮受损后的继发性血栓形成和血管急慢性炎症反应性组织损伤。
作者从上述AMR的病因、到病理变化形成机制的逻辑顺序出发,针对这3个AMR诊断的必要条件,分别探讨如何进一步优化或完善相应的预防和治疗措施。
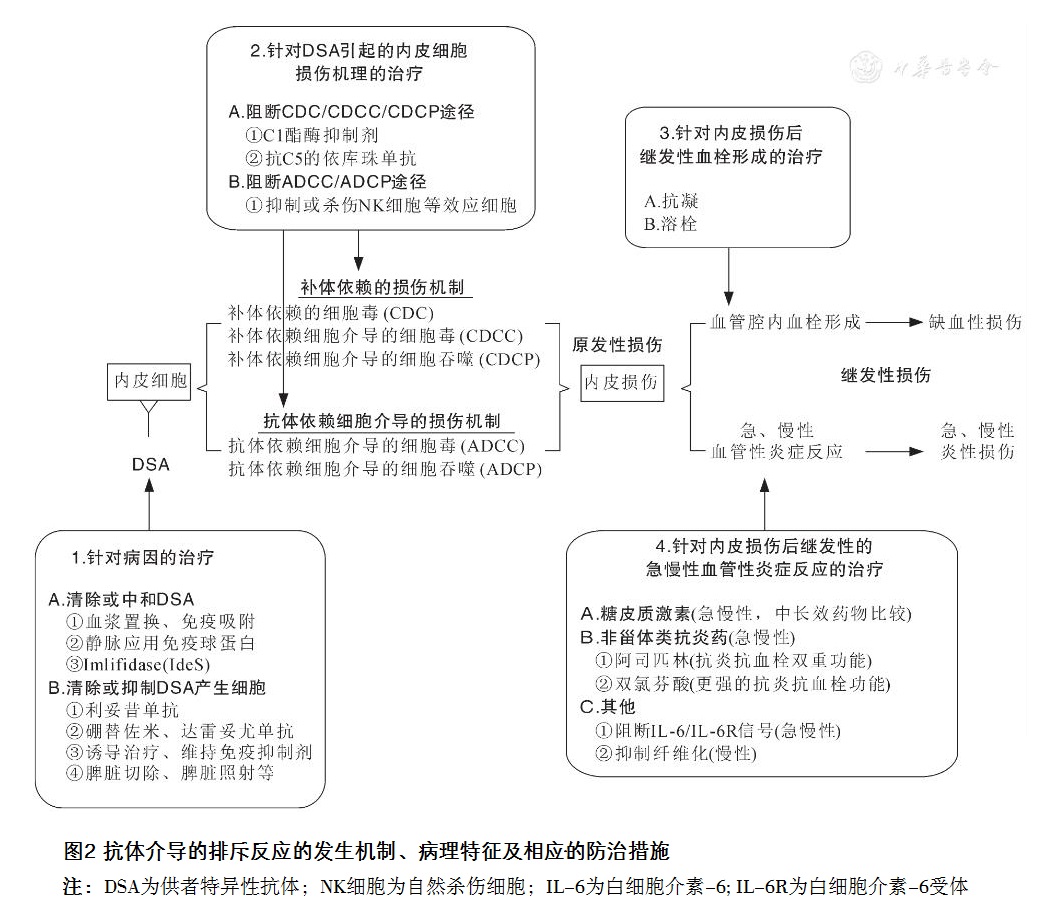
(一)针对病因的防治措施
急性和慢性活动性AMR的共同原发病因是DSA。DSA是移植物受者针对供受者之间错配的、供者特有的异体抗原产生的抗体。DSA包括HLA-DSA和非HLA-DSA,其中HLA-DSA和AMR间关系的研究得最为深入;而由于非HLA异体抗原未知,相应非HLA-DSA引起的AMR尚有待进一步研究。
针对DSA的治疗是AMR的对因治疗,一直以来,都被当作预防和治疗AMR的核心和相关研究的重点。
1.清除或中和DSA
这一类治疗具有快速、有效的特点,但其治疗效果是一过性的,通常需要结合针对DSA产生细胞的治疗以巩固并延长其疗效。
血浆置换和静脉应用免疫球蛋白是目前移植领域使用最为广泛的治疗AMR的方法。分别用于清除和中和外周血DSA,适合在AMR的活动期,外周血中存在大量DSA的情况下使用,可以迅速缓解因DSA而引起的急性病理损伤作用。
近年来,一种提纯于化脓性链球菌的蛋白酶Imlifidase(IdeS)已被应用于临床,它通过将IgG裂解成Fab和Fc片段,使抗体无法实现经由Fc片段介导的、通过CDC或ADCC途径的靶细胞杀伤功能。IdeS用于脱敏治疗和AMR治疗的相关临床试验初期结果显示效果较好,但其长期疗效和相关副作用还需要更多病例的验证。在使用IdeS时需要注意的是,它不能与抗体类诱导治疗剂(抗胸腺细胞球蛋白和巴利昔单抗),和针对B淋巴细胞的利妥昔单抗或针对浆细胞的达雷妥尤单抗联合使用,因为IdeS也有可能降解它们,使它们失效。
2.清除DSA产生细胞或抑制其功能
抗B淋巴细胞CD20的利妥昔单抗、针对浆细胞的化学药硼替佐米和抗浆细胞CD38的达雷妥尤单抗,分别在2002、2015和2019年被用于治疗AMR。
除采用这些针对性的治疗药物来清除B淋巴细胞或浆细胞外,临床上常规使用的诱导治疗剂、维持用免疫抑制剂都有一定程度的直接或间接抑制或杀伤抗体产生细胞的功效。
另外,脾脏切除和更为温和的低剂量脾照射的方法来清除淋巴细胞,也取得了较为满意的效果。其原因为脾脏是人体内最大的淋巴组织,储存了人体内近1/4的淋巴细胞。
3.治疗方案组合使用的必要性
在发生活动性AMR时,可紧急采用清除或中和DSA的治疗,快速降低体内DSA水平,减少因大量DSA而导致的急性组织损伤。但由于移植物的长期存在,产生DSA的浆细胞和上游的B淋巴细胞如不加以控制或清除,DSA水平很快就会恢复。由于清除或中和DSA所能发挥的疗效往往是极其短暂的、一过性的,为了取得更为长期、稳固的AMR防治效果,清除或中和DSA的治疗通常需要和抑制或清除浆细胞、B淋巴细胞的治疗药物或维持用免疫抑制剂联合使用。
4.抗体产生细胞清除剂从应急使用到维持治疗的可行性
抗体产生细胞清除剂的药效往往只能维持相对较短的时间。单独使用时,它们对抗体产生细胞杀伤作用的维持时间通常为数周,但当它们和维持用免疫抑制剂合理配合使用时,疗效可以大大延长。为起到长期预防或治疗AMR的效果,把这些治疗AMR时应急使用的抗体产生细胞清除药物,转化为一种常规、维持性的预防和治疗措施,已经在自身免疫性疾病的长期防治中,取得了较好的效果。另外,在现有的维持免疫抑制剂治疗中加入或替换使用抗体产生细胞清除剂,也可能可以更好地预防和控制AMR。但具体的使用剂量、频率等,还需要在临床应用实践中积累经验。
(二)针对DSA引起的内皮细胞损伤机制的防治措施
DSA主要通过CDC和ADCC途径引起血管内皮细胞损伤,而CDC和ADCP这2种途径在AMR中的作用尚有待进一步研究确认。但在大多数情况下,针对CDC和ADCC途径的治疗措施,也同样适用于CDC和ADCP途径。
1.阻断CDC/CDCC/CDCP途径
针对DSA破坏靶细胞的3种补体依赖性的损伤机制,哪怕无法明确其具体的作用途径,仍然可以通过抑制补体的方法,如通过使用C1酯酶抑制剂、抗C5的依库珠单抗,阻断其对靶细胞的破坏。
在近期的有关移植物受者的IgG类型的HLA-DSA对供者靶细胞的体外毒性作用研究中,才博医学研究发现,在移植物受者体内被检出的HLA-DSA中,真正通过CDC途径最终能杀伤供者靶细胞的只占其中的不到1/3。该结果不仅发现了很多HLA-DSA阳性的AMR受者的病理学活检组织中无法发现补体被激活的证据(C4d的沉着);也解释了为何在没有明确DSA是否通过补体依赖性作用损伤移植物内皮细胞是的情况下,盲目使用补体抑制性治疗,会出现部分受者有效、而对其他受者无效的现象。对于这些补体抑制性治疗无效的受者,很可能其DSA对内皮细胞的杀伤并不是以CDC、CDCC或CDCP为主要作用机制。因此,如果需要采用补体抑制性药物作为防治AMR的治疗措施,最好在治疗前先确认DSA是通过补体依赖性的作用途径杀伤供者靶细胞的。否则,相应的治疗就是无的放矢。
2.阻断ADCC/ADCP途径
ADCC或ADCP介导的作用途径,可以通过抑制或清除杀伤或吞噬细胞的方法,阻断其对靶细胞的破坏。现有的维持用免疫抑制剂可以通过非特异性地抑制效应细胞的细胞因子释放,影响ADCC作用。而特异性针对杀伤或吞噬细胞的治疗,目前多停留在动物试验阶段,尚无相应的临床试验方案面世。
(三)针对内皮损伤后继发性血栓形成的防治措施
移植物的存在,始终是激发移植受者产生抗供者免疫反应的抗原来源。无论是固有免疫系统介导的、细胞介导的,还是抗体介导的抗供者免疫反应,引起组织损伤的首要表现,就是移植物血管内皮的损伤以及继发的血管内血栓形成。移植物血管内血栓形成的最大危害,就是受该血管供应的组织缺血性损伤、坏死。在肾移植中,最典型的改变就是肾小管的缺血性损伤、坏死。因此,抗凝治疗具有防治AMR中内皮损伤后的血栓形成的必要性。
阿司匹林等抗凝药的长期低剂量使用在预防相对较大血管血栓形成中的作用已经非常明确。由于其抗血栓作用的靶点是血小板,因此对微血管血栓的防治作用同样有效。因此,在没有药物使用禁忌证的情况下,抗凝药物的长期、维持使用,是预防移植物微血管内血栓形成的有效手段,也是预防AMR的有效手段。
AMR相关的微血管内血栓的形成,一般只局限于移植物血管。但是,在抗体水平较高情况下进行的移植(如ABO血型不相容)、在有巨细胞病毒感染或存在药物毒性作用的情况下,容易发展为不局限于肾脏等移植物的,以溶血性贫血、血小板减少等为特征的“系统性”的血栓性微血管病(TMA)。而在系统性TMA发生时,由于血小板水平明显降低,抗血小板和抗凝治疗会非常困难,因此一般不建议使用针对血小板的抗凝治疗。
对于药物毒性引起的TMA,如吉西他滨和顺铂,停止使用相关药物即可改善。对于只局限于移植器官的TMA,在没有明显的溶血性贫血、血小板减少等系统性TMA表现时,抗凝溶栓治疗是上述针对抗体和补体等对因治疗的良好对症治疗补充措施。
移植相关的系统性TMA治疗方法和其他原因导致的系统性TMA一样,主要通过更新血浆和抑制补体来清除或抑制血液中的抗体、补体、毒性药物、细胞因子等内皮细胞破坏因素。较早使用的有静脉用免疫球蛋白、血浆置换或补充新鲜冷冻血浆,近年来使用的有抗胸腺球蛋白、依库珠单抗。
另外一点值得提出的是,阿司匹林这一类非甾体抗炎药是非选择性环氧合酶(COX)抑制剂,既有控制血栓形成达到抗凝效果的作用,也有一定的抗炎功能,从而减少排斥反应的发生。Oberkofler等在一项有2365肝移植受者参与的国际性多中心队列研究中发现,低剂量阿司匹林组的1年初级动脉通畅率为99%,无阿司匹林组为96%(HR=0.23,P<0.001);阿司匹林组的1年无排斥生存率为89%,无阿司匹林组为82%(HR=0.77,P=0.01)。这一结果证实了研究前的假设“低剂量阿司匹林不仅有减少血栓形成的风险,也具有强大的抗炎特性,并可能减轻肝移植后的炎症过程,如排斥反应”。
在我国的一些肝脏和肾脏移植中心,移植术后除规范维持使用免疫抑制方案外,也开始常规应用阿司匹林类药物,以预防移植物血管内皮细胞受损后形成血栓。
(四)针对内皮损伤后继发性急慢性血管性炎症反应的防治措施
实体器官移植后发生的AMR,除了引起血管内皮损伤的致病原因DSA具有特殊性之外,血管内皮损伤后的所有继发性病理过程和其他原因导致的内皮损伤后继发性病理改变非常类似,是一个以血管反应为中心环节的炎症反应。这个病理过程是内皮损伤后,在DSA、自身抗体、炎症细胞和炎症介质等共同参与下的损伤、抗损伤和修复的动态过程。因此,抗炎治疗是除了针对抗体或其产生细胞的对因治疗以外的,最为重要的对症治疗措施。
抗炎药有2大类:一类是以糖皮质激素为代表的甾体抗炎药,另一类是以阿司匹林为代表的非甾体抗炎药。这两类药物作用机制的共同点,是它们都围绕炎症反应中由细胞膜磷脂产生的花生四烯酸及其代谢产物产生作用;不同点是糖皮质激素通过抑制磷脂酶A2直接减少花生四烯酸的产生,而非甾体抗炎药则通过抑制进一步代谢花生四烯酸的COX来控制前列腺素和血栓素的产生。
1.糖皮质激素
糖皮质激素是移植后常规使用的维持用免疫抑制剂,也是最为常用的抗排斥药。由于糖皮质激素受体(GR)存在于几乎所有细胞的细胞膜及胞质内,每个细胞的结合位点在5000~20000之间,因此糖皮质激素对人体细胞的影响作用是极为广泛的、全方位的。
糖皮质激素抗炎作用的具体表现有以下3点:第1点为抑制磷脂酶A2,影响花生四烯酸代谢的连锁反应,使得炎症介质前列环素E2、前列腺素、白三烯类等减少,抑制诱导性一氧化氮合成酶和COX-2的表达,从而阻断相关介质的产生,发挥抗炎作用;第2点为抑制多种炎症细胞因子,如肿瘤坏死因子α、白细胞介素(IL)-1、IL-2、IL-6、IL-8的产生,抑制黏附分子如E选择素及细胞间黏附分子-1的表达;第3点为激活胱天蛋白酶和特异性核酸内切酶,导致细胞凋亡等。
基于上述糖皮质激素多途径的抗炎作用机制,对于移植受者,使用糖皮质激素抗炎作用的临床价值,远远超过其免疫抑制功能。糖皮质激素强大的抗炎功能,可用于抑制内皮损伤后继发性的急慢性血管性炎症反应。
对于急性活动性AMR中出现的微血管炎症和动脉内膜炎或透壁动脉炎,糖皮质激素可以通过增高血管的紧张性、减少充血、降低毛细血管通透性来减少渗出和水肿,同时抑制白细胞浸润及吞噬反应,减少各种炎症因子的释放,缓解急性期血管性炎性反应。
对于慢性活动性AMR中出现的以肾小球基底膜出现复层、管周毛细血管基底膜多层化和新生的动脉内膜纤维化,这些以肾小球、管周毛细血管等微小血管,以及管径更大的中小动脉的受损和损伤后增生性修复为主要形态学特征改变,糖皮质激素可以通过抑制毛细血管和成纤维细胞增生,抑制胶原蛋白、黏多糖合成等,缓解慢性期的血管性炎症反应。
针对糖皮质激素在预防AMR中的应用,长期以来,从预防排斥反应发生的角度出发,临床上都将糖皮质激素作为一个重要的预防排斥反应的维持用治疗药物。但由于其在长期维持治疗的临床实践中引起的感染、心脑血管病、肿瘤以及骨质疏松等会严重影响受者的远期存活率和生存质量;因此,在1990至2010年间,人们开始广泛尝试无激素的维持治疗方案。尽管对于无激素治疗方案的受者,临床上通常会提高其他免疫抑制剂的使用剂量,以弥补不用激素后在免疫抑制功能上的缺失,但无法弥补治疗方案中原本依赖于糖皮质激素的强大抗炎功能的缺失。而如上所述,排斥反应在内皮细胞受损后的特征性病理改变实际上就是血管性的炎症反应性病变。这就是为何在无激素治疗方案中出现的问题,不仅包括急性排斥反应发生率明显上升,也包括因慢性排斥反应发生率上升而最终影响移植物长期存活。这使得绝大多数无激素治疗方案的受试者不得不重新回到包含激素的维持治疗,或需要重新寻找合适的治疗方案。
正是由于临床上确实存在既要尽可能减少糖皮质激素副作用,又要很好控制AMR发生的实际需求,如何判断无激素治疗的适应证受者变得尤为关键。
在糖皮质激素是否需要长期维持使用方面,作者建议把受者分成AMR低风险受者和AMR高风险受者区别对待。没有AMR病因DSA的检出、没有病理学的急慢性AMR的组织损伤表现、没有组织损伤标志物(可溶性HLA、供者来源游离细胞DNA、自身抗体)的AMR低风险受者,可以停用激素,仅用其他维持免疫抑制剂治疗,并定期检测上述3类组织损伤标志物,根据情况,及时调整用药。对于AMR高风险的受者,他们外周血中有DSA检出、有病理学的组织损伤表现或有组织损伤标志物检出的,不建议停用激素。
但是,对于因为难以耐受糖皮质激素的副作用而不得不停用时,可以考虑副作用相对较低的非甾体类抗炎药,结合其他维持用免疫抑制剂,来预防原发性的内皮损伤和继发性的血管性炎症反应。
针对糖皮质激素在AMR治疗中的应用,临床实践中,单纯依靠糖皮质激素冲击治疗,常存在无法很好地控制活动性AMR的情况。其原因是,尽管使用激素可以快速控制血管内皮损伤后的继发性血管性炎症反应,但其对于抗体及抗体引起的原发性内皮损伤、内皮损伤后的血栓性微血管病变及以后续因缺血缺氧引起的肾小管损伤及坏死等,没有即时治疗作用。基于AMR发生和发展的病理学机制,从对因治疗和对症治疗并重的角度出发,在AMR治疗时,既要考虑控制抗体及其引起的原发性内皮损伤,也要兼顾血管内皮受损后的继发性血管性炎症反应。因此,在没有找到抗炎作用更强、副作用更小的替代治疗方案前,利用糖皮质激素抗炎功能进行对症治疗,联合清除或中和抗体、清除或抑制抗体产生细胞等对因治疗,在AMR治疗中缺一不可。
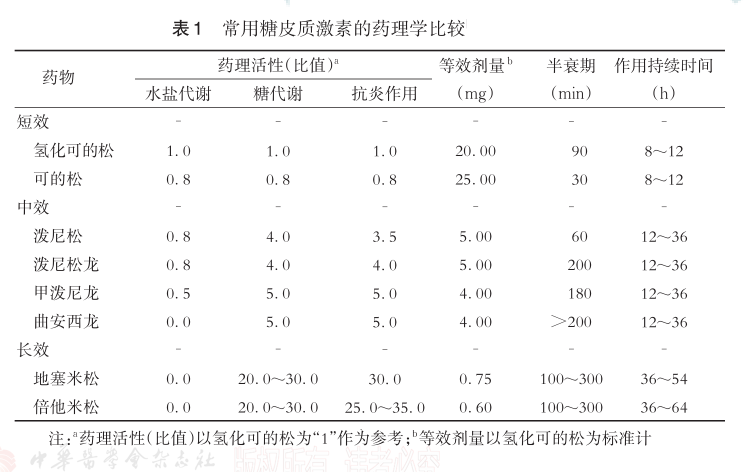
短效、中效和长效糖皮质激素在抗炎作用强度方面差异较大。其中,口服泼尼松龙、静脉注射甲泼尼龙和静脉注射地塞米松,在移植受者的排斥反应治疗中都有较为广泛的使用。尽管在20世纪90年代,有单中心研究发现,在11例接受口服泼尼松龙(OP组)、119例接受静脉注射甲泼尼龙(IVMP组)、和48例接受静脉注射地塞米松(IVDX组)治疗的急性排斥反应受者中,共有154例(86%)对抗排斥治疗表现出完全或部分反应;其中OP组、IVMP组和IVDX组的治疗反应分别为91%、85%、和90%,各组间的治疗有效率和副作用比较,差异均无统计学意义。但由于各受试组中受者的数量和基本情况都存在较大差异,因此该研究结果不一定能代表实际治疗效果的真实情况。
长效糖皮质激素如地塞米松在治疗内皮细胞损伤后血管性炎症反应的临床应用较常见,尤其是近年来用于缓解COVID-19患者的内皮细胞损伤,及内皮损伤后的血管性炎症反应,且都取得了良好的治疗效果。在血管移植中发现,地塞米松的短期抗炎效果可能通过减少促炎细胞因子等途径,保护血管免受炎性反应损伤,从而显著减少慢性血管性炎症反应中以管壁增厚为特征的形态学病变。但地塞米松在器官移植排斥反应中的血管性炎症反应治疗方面,尚无相关的文献报道。在综合考虑抗炎作用强度、作用持续时间、药物使用剂量、糖代谢和水盐代谢副作用控制等因素的情况下,临床上可以考虑尝试使用抗炎作用最强的地塞米松类长效糖皮质激素,来治疗排斥反应中的血管性炎症反应,并与较常使用的中效糖皮质激素作一系统性比较,以得到较为客观的疗效数据,这可能会为更好地控制排斥反应提供可靠的临床数据支持。
2.非甾体抗炎药
以阿司匹林为代表的非甾体抗炎药被推荐用于排斥反应治疗。DSA等作用因子引起血管内皮损伤后,首先出现的是肾小球和管周毛细血管等微血管内血栓形成这一共同病理改变,而阿司匹林通过抑制花生四烯酸代谢通路上的COX,不仅可以减少血小板中的血栓素生成,进而影响血小板的聚集和血栓形成,达到抗凝效果;而且,阿司匹林也可以通过抑制前列腺素等重要炎症介质的产生,达到抗炎效果。因此,阿司匹林对继发于内皮损伤后的血管性炎症反应也有相应的治疗功能。
从现有的临床证据看,阿司匹林在移植后血栓形成的治疗,以及抑制慢性血管性炎症反应特征性的血管炎性反应、纤维化改变,甚至延长移植物长期存活方面都有相应的临床研究支持。由于以阿司匹林为代表的非甾体抗炎药具备抗凝和抗炎的双重治疗功能,恰好可以针对性治疗AMR中出现的微血管血栓形成和内皮损伤后的继发性急慢性炎症反应,因此,阿司匹林的短期或长期预防性的应用,都值得移植临床重点关注。
除此之外,其他非甾体抗炎药(如双氯芬酸)的作用机制和阿司匹林类似,且同时具有抗炎和抗血栓的双重作用,而其抗炎作用活性是阿司匹林的数十倍,副作用和阿司匹林类似。尽管双氯芬酸尚未在AMR预防和治疗中使用,但是其潜在应用价值,值得进行进一步深入研究。
需要指出的是,对于老年人群和低血容量、高剂量暴露、使用钙调神经磷酸酶抑制剂等血管收缩剂、使用肾素-血管紧张素-醛固酮系统(RAAS)抑制剂或利尿剂的受者,非甾体抗炎药会有增加其肾毒性作用。因此,在其临床应用时,需要全面考量药物的使用剂量、使用时长及副作用等!
3.其他治疗药物
(1)阻断IL-6/IL-6R信号
IL-6是促炎细胞因子家族的一员,可诱导多种急性炎症蛋白的表达,在人类细胞因子网络中发挥着重要作用,影响或决定人体多种细胞的增殖和分化。IL-6被越来越多认为是参与同种异体移植损伤的关键促炎细胞因子,并被证明在调节移植后的炎症反应和同种异体免疫反应中发挥关键作用。
来自初步临床试验的数据显示,在异体免疫刺激下,IL-6水平上升引起的血管性炎性反应,可以通过托珠单抗[抗IL-6受体人源化抗体(抗IL-6R)]和克拉扎珠单抗(抗IL-6)的治疗加以控制。因为抗IL-6/IL-6R的治疗已经显示了在体内具备诱导调节性T细胞和调节性B细胞的能力,这可能对预防和治疗DSA的发展和异体移植排斥反应具有潜在的重要性。
与既有免疫抑制功能又有强大广谱抗炎功能的激素及以阿司匹林为代表的未来有可能成为排斥反应中抗炎治疗选择的非甾体抗炎药相比,单纯抑制或阻断IL-6/IL-6R信号通路,是否能达到更好的AMR治疗的效果,还需要临床研究的进一步探讨。
(2)抑制纤维化
由于慢性活动性AMR的主要病理学改变是以内皮细胞的慢性持续性受损后的组织再生和纤维化改变为主要特征。在肾移植中,具体表现为肾小球基底膜和管周毛细血管这些微小血管的基底膜纤维化和动脉内膜纤维化等。因此,控制慢性排斥反应中组织纤维化的进程,可能为研究者提供了一个特异性针对慢性活动性AMR的治疗思路。
例如,转化生长因子-β (TGF-β)既是有免疫抑制功能的细胞因子,又与慢性炎症反应中和移植物组织损伤后修复中发生的组织纤维化密切相关。针对TGF-β作用通路的抑制剂或许对慢性排斥反应中的纤维化有较好的治疗作用。
尽管糖皮质激素有抑制成纤维细胞增生,抑制胶原蛋白和黏多糖合成等功能,从而达到控制纤维化进程的效果;特异性针对组织纤维化这一慢性AMR中特征性病理改变的治疗,结合副作用相对较小的非甾体类抗炎药物治疗,可能有其独特的治疗优势。
四、AMR综合防治的建议方案
上述基于AMR发生和发展机制的防治措施,都有其各自不同的适应证。作者分别针对非致敏和致敏受者中AMR的预防以及急性和慢性活动性AMR的治疗,提出相应的对因治疗和对症措施相结合的建议方案。
(一)AMR的预防
移植受者在手术前通常需要接受致敏状态评估。非致敏等待者是指在移植前体内没有预存抗体的患者,他们接受移植手术后发生AMR的风险较低。而致敏等待者是指在移植前体内有预存的HLA或非HLA异体抗体的患者,他们接受移植手术后发生AMR的风险较高。
根据致敏状态的检测结果,可将受者分为下列4类:非致敏受者、致敏受者(有DSA)、致敏受者(不一定有DSA)、疑似致敏受者。针对不同种类受者,AMR的预防方式有所不同。

1.非致敏受者AMR的预防
(1)移植前的预防
为了尽可能降低移植受者在接触移植物时的基础免疫水平,建议在条件允许的情况下,尽可能在移植前1~2周,甚至更早的时间点开始,进行诱导治疗。目前临床上采用的诱导治疗剂,除了可以特异性地杀伤或抑制T淋巴细胞,也可直接或间接杀伤或抑制B淋巴细胞。
(2)移植后的预防
①针对DSA产生细胞的治疗:非必需治疗,因维持用免疫抑制剂通常有非特异性杀伤或抑制抗体产生细胞的作用。
②抗凝治疗:非必需,但建议预防性采用;随访检测中发现相关病理学证据后,必需采用。
③抗炎治疗:非必需,但建议预防性采用;随访检测中发现相关病理学证据后,必需采用。
④早期发现潜在AMR风险,具体方法为定期监测AMR病因DSA(HLA和非HLA)和定期监测组织损伤指标(如在早期出现的可溶性HLA和供者来源的游离细胞DNA及相对较晚发生的自身抗体)。
部分受者体内可能有预存的自身抗体,通常和本次移植无关,并且移植后会因为免疫抑制剂的使用而下降或消失。应特别关注是否有新生的自身抗体或移植后水平明显增加的自身抗体。
2.致敏受者(有DSA)AMR的预防
有DSA的致敏受者通常不建议马上进行移植,而是等待下次移植机会。如果是必须进行的活体移植,则应该进行脱敏治疗,治疗方案以清除或中和抗体治疗为首选,同时结合清除或抑制抗体产生细胞的治疗;脱敏治疗后需判断疗效并评估是否适宜进行移植。
(1)移植前的预防
抗体清除并采用含有可杀伤抗体产生细胞的方案,在移植前1~2周或更早的时间点,尽早进行诱导治疗。
(2)移植后的预防
①针对DSA的治疗:作为可选方案,具体应根据术后DSA检测的实际情况来判断。如果预存DSA水平术后有明显上升(>20%)或出现新生的DSA,尤其是当DSA有明显杀伤供者抗原细胞的功能时、有病理学组织损伤表现或外周血中有组织损伤标志物的明显增加时,应首先考虑进行清除或中和抗体治疗。
②针对DSA产生细胞的治疗:非必需治疗方案,但可以根据情况加以考虑。因为尽管维持用免疫抑制剂通常有非特异性杀伤或抑制抗体产生细胞的作用,但对于致敏受者,维持免疫抑制剂清除或控制DSA产生细胞的作用可能不够,需要另行增加针对B淋巴细胞或浆细胞的治疗措施。
③抗凝治疗:必选的对症治疗,只要DSA这个致病因子存在,无论是预存或新生的,都有可能进一步引起原发性的内皮损伤和继发性的微血管血栓。
④抗炎治疗:必选的对症治疗,只要DSA这个致病因子存在,无论是预存或新生的,都有可能进一步引起原发性的内皮损伤和继发性的微血管炎症反应。
3.致敏受者(不一定有DSA) AMR的预防
此类受者致敏状态的确认需要根据细胞学PRA的检测结果,但PRA的检测结果无法判断有无DSA,应尽快选用细胞学供受者交叉反应法或细胞学DSA确认检测法,判断有无DSA。根据DSA确认性验证的阴性或阳性结果,分别按非致敏受者或致敏受者(有DSA)的预防措施执行。
4.疑似致敏受者AMR的预防
疑似致敏受者的确认通常是根据流式点阵仪或Luminex的纯化抗原(HLA或MICA)检测法的结果。由于存在变性抗原引起假阳性抗体检测结果的可能,检出的疑似致敏受者需要进行DSA真实性验证。根据DSA真实性验证的阴性或阳性结果,分别按非致敏受者或致敏受者(有DSA)的预防措施执行。
(二)急性活动性AMR的治疗
急性活动性AMR较多发生在移植术后早期(通常在1个月以内),也可能发生在术后较晚的其他时间点。
移植术后早期发生的活动性AMR,除了由术前的预存DSA、术后较早期出现的新生IgM-DSA和术后较晚期出现的新生的IgG-DSA引起的原发性内皮损伤之外,部分移植物还可能存在因缺血再灌注而导致的内皮细胞损伤。因此,在双重内皮细胞损伤因素作用的基础上,移植术后早期发生的AMR的临床和病理表现往往比后期发生的AMR更为突出,微血管管腔内的血栓形成、急性肾小管损伤、微血管的急性炎症反应等病理学表现更常被检出。
根据上述急性活动性AMR的特征,作者提出如下的治疗原则:
①首选针对DSA的对因治疗,可以快速缓解AMR。但应注意其效果是短暂的、一过性的。
②次选针对DSA产生细胞的对因治疗,和针对DSA的治疗联合使用,可以巩固AMR治疗疗效。
③阻断补体依赖性损伤机制的治疗:非必选,但如果DSA的细胞学功能检测确认DSA通过CDC作用破坏供者细胞,则可以考虑采取阻断CDC作用途径的治疗措施,如C1酯酶抑制剂或抗C5的依库珠单抗等,加强针对DSA的治疗在控制AMR时的治疗效果。
④抗凝和必要时的溶栓治疗:必选的对症治疗,用以有效控制内皮损伤后的继发性血栓性微血管病。尽管微血管管腔内血栓形成可能发生的范围大小不一、严重程度不一,但它是活动性AMR发生过程中必然出现的组织学改变,因此抗凝治疗是活动性AMR必选的对症治疗。如果有疑似或明确的血栓形成证据,也应考虑相应的溶栓治疗,而具体的治疗方案可根据组织学改变的严重程度作相应调整。
⑤抗炎治疗:必选的对症治疗,用以有效控制内皮损伤后的继发性微血管炎和后续的动脉内膜炎和透壁动脉炎。尽管微血管炎症可能发生的范围大小不一、严重程度不一,但内皮损伤后的微血管炎等同样是急性AMR发生过程中必然出现的组织学改变。因此抗炎治疗也是急性AMR必选的对症治疗,而具体的抗炎治疗方案可根据组织学改变的严重程度作相应调整。
(三)慢性活动性AMR的治疗
慢性活动性AMR的发生和发展,往往呈现出相对隐匿但又持续进展的急慢性组织损伤表现兼有的病理过程,通常在没有常规监测DSA并及时采取预防性治疗措施的受者或者在监测中发现了DSA但未能有效控制的受者中发生。
在病理表现方面,慢性活动性AMR和急性活动性AMR的差别较为显著:慢性活动性AMR常常不仅有微血管血栓和微血管炎等因急性血管性炎症反应引起的组织损伤表现,同时也有因血管性炎症反应迁延不愈成为慢性,而导致的慢性组织形态学的改变,如肾小球和管周毛细血管基底膜纤维化等。慢性活动性AMR中,内皮损伤的严重程度相对较轻,引起的微血管管腔内血栓形成和微血管炎症反应也相对较轻。微血管炎症也以慢性炎症为主要表现形式,即以单核细胞、淋巴细胞、或浆细胞浸润为主。
根据慢性活动性AMR的上述特征,作者提出如下的治疗原则:
①清除或中和DSA的治疗:非必选,因为DSA一旦产生,就很难彻底清除,其效果是快速的但一过性的。建议在抗体水平较高、组织损伤证据明确时使用。DSA的长期控制依赖于针对DSA产生细胞的治疗。
②清除或抑制DSA产生细胞的治疗:是首选治疗,目的是长期稳定控制DSA水平。可以考虑长期维持使用,或短期使用后结合维持免疫抑制剂治疗。可通过定期监测靶细胞和DSA水平的动态变化,观察其疗效。
③阻断补体依赖性损伤机制的治疗:非必选,确认DSA是通过CDC作用破坏内皮细胞和针对DSA或针对DSA产生细胞的治疗不能很好地控制AMR时可以考虑使用。
④抗凝和必要时的溶栓治疗:是必选的对症治疗,因为微血管管腔内的血栓形成是“活动性AMR”的特征性病理学表现,因此抗凝治疗可用于控制已发生的或预防潜在的微血管内血栓形成。如果有疑似或明确的血栓形成的证据,也应考虑相应的溶栓治疗。
⑤抗炎治疗:由于慢性活动性AMR的病理特征是在慢性炎症反应的基础上,同时存在“活动性”AMR的病理特征(即急性血管性炎症反应表现)。因此抗炎治疗的目的既是针对慢性炎症,同时又是针对“活动性”AMR中的急性炎症反应必选的对症治疗方式。
文章最后,作者指出,本文所阐述的AMR防治方案,是建立在目前对AMR的诊断、发生机制及病理学表现的认知基础之上的,但在AMR的病因学诊断和发生机制方面,仍然存有较多疑问,有待进一步剖析。这些问题包括但不限于:①如何正确判断HLA-DSA的真实性并确认其损伤靶细胞的机制?②如何在绝大多数非HLA异体抗原未知的情况下,解决非HLA-DSA的检测问题,从而避免由非HLA-DSA引起的AMR漏诊?③在AMR作用机制中,除了CDC和ADCC作用机制外,CDCC、CDCP和ADCP作用机制是否确实存在,NK细胞、单核细胞、巨噬细胞、中性粒细胞等是否实际参与,哪类细胞起主导作用?
作者强调,针对抗体和抗体产生细胞的对因治疗是AMR防治中最为重要的措施,这一点毋庸置疑;但是抗凝、溶栓和抗炎等对症治疗措施在AMR防治中的重要性目前仍被大多数临床医生所忽视。因此,在AMR的防治中,应全面考虑受者情况,制定更为精准的诊疗策略。
本文仅供学习参考,完整准确内容请查阅原始文献:蔡俊超,庆欣,张雷,朱兰,刘龙山,田普训,陈刚.抗体介导排斥反应的精准诊疗[J].中华器官移植杂志,2024,45(01):1-17.
DOI:10.3760/cma.j.cn421203-20231031-00148
https://rs.yiigle.com/cmaid/1496678
【链接】
蔡俊超:如何更好地预防和治疗器官移植后抗体介导的排斥反应
https://bbs.yizhiwang.org.cn/forum.php?mod=viewthread&tid=87816
王祥慧:抗体介导的排斥反应的预防和治疗手段
https://bbs.yizhiwang.org.cn/forum.php?mod=viewthread&tid=88112
摘读:肾移植排斥反应临床诊疗技术规范(2019版)
https://bbs.yizhiwang.org.cn/forum.php?mod=viewthread&tid=87275
|