肾移植是目前终末期肾病患者的首选治疗方法,但移植肾丢失仍是许多受者最终面临的问题,每年有30000多例透析患者者加入肾移植的等待名单,而每年有4000多例患者死于等待过程。长期透析显著降低患者的生活质量,再次移植往往是生存和健康的最佳机会,已经确定约25%~39%的肾移植失功受者重新在等待名单上,而且占所有等待患者约15.3%的稳定比例,越来越多的研究也证明再次移植能够提供更好的生活质量和可以接受的长期结果。但再次移植也面临着诸多的问题,再次移植物的存活率似乎比第一次移植物低10%,也有研究报道两者无显著性差异。
空军军医大学西京医院回顾性分析2005年1月至2020年1月32例多次肾移植患者的临床资料,研究显示再次移植的移植物存活率显著高于该组患者的首次移植。
一、一般资料
(1)二次肾移植患者的临床资料
二次肾移植29例,男23例,女6例,初次肾移植平均年龄32.5±10.5(16~53)岁,二次肾移植平均年龄40.3±11.8(25~63)岁,两组在年龄、男女比例方面无统计学差异。
29例二次肾移植,其肾脏的原发病和首次移植肾失功的原因见表1。

二次移植等待时间为2周至8年,其中6个月内7例,6个月至1年者8例,超过1年14例,最长为8年。
首次肾移植尸体供肾27例[含公民逝世后器官捐献(DCD 3例)],亲属活体供肾2例,二次肾移植均为尸体供肾(含DCD 25例),其中3例肾移植联合脾窝异位辅助性肝移植,1例为肝胰肾联合移植。
肾移植联合脾窝异位辅助性肝移植患者中1例合并慢性丙型病毒性肝炎,1例合并慢性乙型病毒性肝炎,1例肝胰肾联合移植患者为慢性乙型病毒性肝炎后肝硬化、肝功能不全合并慢性肾功能不全伴慢性胰腺炎导致胰岛素依赖型糖尿病。
(2)三次肾移植患者的临床资料
三次肾移植3例,均为男性,既往移植手术均在外院进行。首次移植年龄21~26岁,二次肾移植年龄27~34岁,三次肾移植年龄38~44岁,肾脏原发病因不详。
二次移植原因分别为慢性移植肾肾病2例,超急性排斥反应1例。三次移植原因分别为慢性移植肾肾病2例,超急性排斥反应1例。
二次移植等待时间为1月至1年,三次移植等待时间为2月至13年。其中1例第3次为亲属活体供肾,其余均为尸体供肾。
二、二次移植术前准备及术中情况
29例均行群体反应性抗体(PRA)检测,其中18例小于10%,4例为10%~30%,7例大于30%,最高为92%。PRA大于30%的7例患者术前行Luminex抗体细分检查,供者特异性抗体(DSA)平均荧光强度(MFI)>1000为阳性,DSA阳性3例,其中6例在围手术期行血浆置换,5例同时行B细胞清除治疗(利妥昔单抗注射液),3例肾移植联合脾窝异位辅助性肝移植,术前淋巴细胞毒性试验(CDC)均阴性。29例均行HLA配型,6位点错配为1~4个,供肾热缺血时间4~10min,冷缺血时间3~16h。
保留原移植肾25例,切除原移植肾4例。
除1例肝胰肾联合移植患者术前HBV-DNA 1.5×10^7IU/ml,其余合并病毒性肝炎患者术前HBV-DNA<100IU/ml,高敏HCV-RNA阴性。肝胰肾联合移植术式为胰液空肠内引流式及原位背驮式同期肝、胰、十二指肠、肾联合移植术。
三、三次移植术前准备及术中情况
3例患者在三次移植前均行群体反应性抗体(PRA)检测,其中2例均为阴性,首次肾移植均为右侧髂窝,二次移植为左侧髂窝,三次肾移植切除其右侧原移植肾,保留另一侧原移植肾。三次移植血管吻合为髂外动、静脉端侧吻合,避开上次移植的吻合区域。
另1例PRA为70%~90%,前两次均为尸体肾移植,均因超急性排斥反应切除原移植肾,三次移植行亲属活体肾移植,HLA零错配。供肾热缺血时间3~8min,冷缺血时间1~10h。
四、移植术后用药情况
PRA>30%且DSA阴性患者围术期应用静脉注射人免疫球蛋白(IVIG)2g/kg,多克隆抗体(兔抗人胸腺细胞免疫球蛋白注射液)50mg,手术当日至术后第4天(d0~4)。
PRA阳性且<30%患者围术期应用IVIG 2g/kg,多克隆抗体(兔抗人胸腺细胞免疫球蛋白注射液)50mg d0,25mg d1~5,注射用甲泼尼龙琥珀酸钠750mg d0,500mg d1~2,250mg d3,120mg d4至口服。
免疫抑制方案采用麦考酚酸(MPA)+钙神经蛋白抑制剂(CNI)+肾上腺糖皮质激素(激素)三联治疗。他克莫司(FK506)起始剂量为0.10~0.15mg/kg,术后1个月时血药谷浓度维持在6~10ng/ml,环孢素A(CsA)起始剂量为4~5mg/kg,术后1个月时CsA血药浓度维持在200~250ng/ml,以后根据血药浓度调整CNI药物剂量。吗替麦考酚酯(MMF)起始剂量1.5g/d,麦考酚钠(MPS)起始剂量为1080mg/d。口服激素甲泼尼龙片起始剂量48mg/d,每日减量4~16mg,术后3个月剂量为4mg。
所有患者术后常规使用头孢菌素预防细菌感染,更昔洛韦预防巨细胞病毒感染。术后1个月开始给予复方新诺明预防卡氏肺孢子虫感染,疗程3个月。
五、DSA阳性患者围手术期处置情况
DSA阳性患者3例,PRA均>30%,一例行肾移植联合脾窝异位辅助性肝移植手术,术前DSA所在位点分别为DR8(MFI:4452)、DQ6(MFI:13841),术前未行脱敏治疗,围手术期多克隆抗体(兔抗人胸腺细胞免疫球蛋白注射液)75mg d0,50mg d1~6,IVIG20gd0,10g/d,d1~6,注射用甲泼尼龙琥珀酸钠1gd0,500mg d1~2,250mg d3至口服,免疫抑制方案同前。
另两例DSA阳性患者行常规肾移植术,术前DSA分别为B57(MFI:9992);B13(MFI:10971),术前2~3次血浆置换,术前1天利妥昔单抗注射液375mg/㎡,DSA阳性复查结果分别为B57(MFI:3623);B13(MFI:1077),术后兔抗人胸腺细胞免疫球蛋白注射液50mg d0~4,IVIG 20g/d d0~6,注射用甲泼尼龙琥珀酸钠750mg d0,500mg d1~2,250mg d3,120mg d4至口服,免疫抑制方案同前。
六、二次移植结果
29例二次肾移植病例,术中超急性排斥反应1例,切除移植肾恢复透析,该患者术前PRA>30%,因当时技术原因未行DSA检查,术前给予免疫吸附治疗,术后切除移植肾后未再复查PRA。
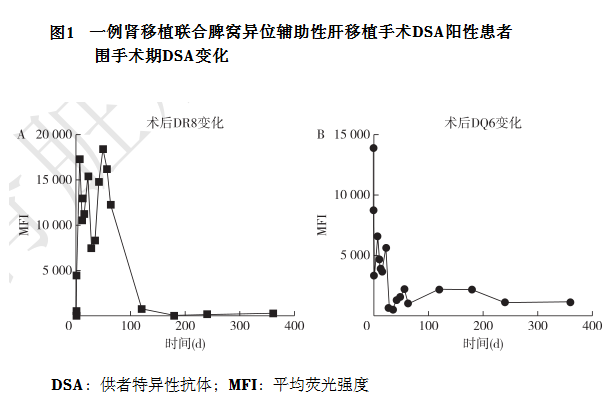
急性排斥反应2例,其中1例为DSA阳性患者,行肾移植联合脾窝异位辅助性肝移植手术,术后1周出现急性排斥反应,利妥昔单抗注射液375mg/㎡,1次,同时给予血浆置换,维持9d,IVIG 10g/d,维持5d,兔抗人胸腺细胞免疫球蛋白注射液50mg,维持5d,血清肌酐逐渐恢复至131μmol/L,术后2~3个月内DSA上下波动,2~3月后逐渐下降(图1),术后荧光强度最高为DR8(MFI:18377)、DQ6(MFI:8700),术后1年复查DSA结果分别为DR8(MFI:271)、DQ6(MFI:1664),血清肌酐维持正常范围内。另1例患者为PRA>30%,DSA阴性,行肾移植联合脾窝异位辅助性肝移植手术,术后1月急性排斥反应导致移植肾失功恢复血液透析,因患者自身情况术后未再行DSA复查。
1例原发性移植肾无功能,首次肾移植即为原发性移植肾无功能,原发病不详,PRA阳性,DSA阴性。
二次肾移植术后超急性排斥发生率为3.4%,急性排斥发生率6.9%,原发性移植肾无功能发生率3.4%,且预后情况优于初次肾移植。1例术后1年因恶性肿瘤移植肾带功死亡,2例术后2年因脑血管意外移植肾带功死亡,二次移植的1年、3年人/肾存活率分别为96.6%/89.7%,89.7%/86.2%,与该组患者首次移植(1、3年肾存活率分别为79.3%,65.5%)相比显著增加,有明显差异(P<0.05)。
二次移植肾中3例肾移植联合脾窝异位辅助性肝移植,2例预后良好,1例DSA阳性移植肾带功存活>5年,1例存活>3年,1例术后1月时因急性排异反应导致移植肾失功恢复血液透析。1例肝胰肾联合移植首次肾移植因急性排斥反应于术后16天切除原移植肾后行二次肾移植,目前联合器官带功存活大于15年,目前是世界同类手术存活时间最长者。
七、三次移植结果
3例均恢复良好,1例PRA阳性,DSA均阴性,术后未发生排斥反应,1年及3年人/肾存活率均为100%,1例人肾存活超过10年。
据报道,西京医院率先在国内开展肾移植联合脾窝异位辅助性肝移植治疗高致敏尿毒症患者,取得一定的临床效果。脾窝异位辅助性肝移植可减少手术操作难度,在肾移植前辅助性肝移植可以预防术后超急性高敏感受体排斥反应,提高移植肾长期存活率,但具体的保护性机制需要进一步的进一步的理论研究。
本文仅供学习参考,完整准确内容请查阅原始文献:李智斌,张更,刘克普,阮东丽,王会龙,田春娟.多次肾移植患者的预后及影响因素[J].肾脏病与透析肾移植杂志,2021,30(01):49-53.
|