|
|
钙调磷酸酶抑制剂(CNI)、霉酚酸(MPA)和糖皮质激素(激素)是目前肾移植后“金标准”免疫抑制方案。MPA为抗增殖类免疫抑制剂,通常与他克莫司或环孢素以及激素联合应用,目前广泛使用的MPA类药物包括吗替麦考酚酯(MMF)和麦考酚钠肠溶片(EC-MPS)。
肾移植受者的MPA血药浓度受多种因素影响,包括种族、性别、年龄、血清白蛋白水平、药物剂型、伴随用药和基因多态性等。儿童身高和体质量随年龄增长有很大的差异,肾移植前后儿童发育也与正常儿童不同,而如红细胞压积和血清白蛋白等指标与年龄显著相关。另外,不同药物剂型效果也不同,因此儿童肾移植用药考验移植科医师的水平。
郑州大学第一附属医院肾移植科对本中心儿童肾移植受者MPA暴露率、不同药物剂型在儿童肾移植受者血药浓度中的差异进行了研究。初步观察发现,不同年龄段MPA浓度的差异主要在服用EC-MPS受者中存在,EC-MPS在儿童期暴露较青春期高。
一、研究对象
纳入郑州大学第一附属医院肾移植科自2017年5月至2022年1月接受心脏死亡器官捐献(DCD)儿童肾移植受者73例。其中男49例,女24例,年龄13(8,15)岁,身高(139±22)cm,体质量(34±14)kg。原发病包括慢性肾小球肾炎42例,肾病综合征8例,新月体型肾小球肾炎7例,局灶节段性肾小球硬化5例,中性粒细胞胞质抗体相关性肾炎5例,多囊肾3例,IgA肾病2例,先天肾发育不良1例。术前69例规律透析(血液透析45例,腹膜透析24例),透析时间10(6,17)个月。
纳入标准:(1)移植时年龄≤17岁;(2)血型鉴定符合输血原则,群体反应性抗体(PRA)<10%,人类白细胞抗原(HLA)相配≥3个位点,补体依赖淋巴细胞毒性试验阴性(<5%);(3)术后采用MPA+他克莫司+激素三联免疫抑制方案,且随访期间未更换药物;(4)术后半年内规律随访复查,并且有至少一次复查MPA浓度。
排除标准:(1)二次移植者;(2)发生严重外科并发症者;(3)随访期间移植肾切除者;(4)各种原因失访者。
根据移植术后服用药物剂型不同,分为:A组,服用MMF胶囊(骁悉,上海罗氏制药)、B组,服用EC-MPS(米芙,瑞士诺华制药)、C组,服用MMF分散片(赛可平,杭州中美华东制药)。
各组再按移植时患者的年龄分为≤12岁年龄段(34例)和>12岁年龄段(39例)。其中A、B、C组≤12岁年龄段分别为16例、13例、5例,>12岁年龄段例数分别为21例、15例、3例。
A组37例,其中男25例,女12例,年龄13(9,15)岁,身高(142±20)cm,体质量指数(16.9±2.7)kg/m2,术前36例透析,透析时间11(5,18)个月;
B组28例,其中男19例,女9例,年龄13(8,15)岁,身高(139±21)cm,体质量指数(16.7±3.1)kg/m2,术前26例透析,透析时间10(7,15)个月;
C组8例,其中男5例,女3例,年龄11(4,16)岁,身高(130±33)cm,体质量指数(16.5±2.2)kg/m2,术前7例透析,透析时间10(5,12)个月。
免疫抑制方案:术后随访期间免疫抑制方案采用MPA+他克莫司+激素三联免疫抑制方案。MMF给药剂量为25mg/kg/d,EC-MPS给药量为18mg/kg/d,1000mg MMF与720mg EC-MPS摩尔量相同。他克莫司剂量为0.10~0.15mg/kg,维持谷浓度在6~8ng/mL,并通过随访复查他克莫司谷浓度、尿量、肾功能、淋巴细胞免疫情况调整用药方案。
二、结果
(一)3组MPA血药浓度比较
肾移植术后随访半年内复查MPA浓度,计算复查MPA浓度时当次A、B、C组每日给药剂量分别为(24.1±3.7)、(18.8±2.8)、(24.8±2.5)mg/kg/d。A组≤12岁和>12岁年龄段儿童的药物剂量分别为(25.5±4.8)、(23.8±2.7)mg/kg/d;B组分别为(19.5±3.5)、(18.1±1.8)mg/kg/d;C组分别为(25.2±2.7)、(24.1±2.6)mg/kg/d,差异均无统计学意义(均为P>0.05)。
A、B、C组各时间点MPA血药浓度比较见表1,差异均无统计学意义(均为P>0.05)。
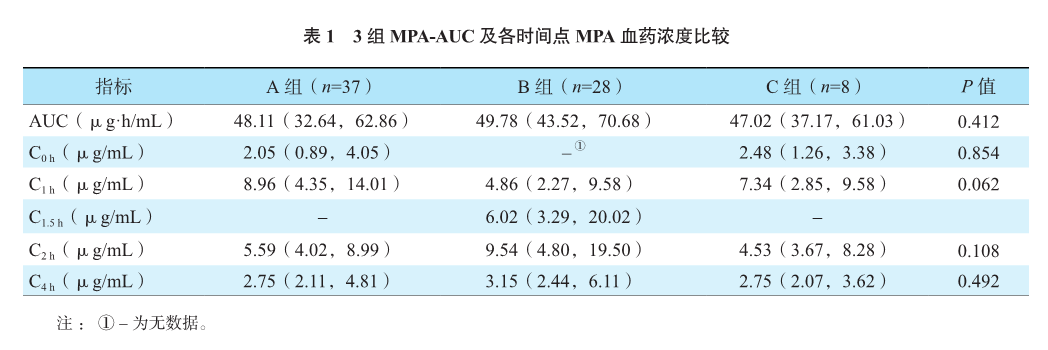
≤12岁年龄段儿童的MPA-C4h、AUC较>12岁年龄段高,分别为4.11(2.43,6.71)μg/mL比2.61(2.04,4.24)μg/mL、53.01(42.00,75.15)μg·h/mL比43.62(33.09,54.29)μg·h/mL,差异均有统计学意义(均为P<0.05);两年龄段MPA-C2h比较,差异无统计学意义[6.45(4.00,14.46)μg/mL比5.66(4.73,9.43)μg/mL,P=0.630]。
B组≤12岁年龄段儿童MPA-C4h较>12岁年龄段高,差异有统计学意义[5.78(2.71,8.20)μg/mL比2.65(1.85,3.79)μg/mL,P=0.016],MPA-AUC较>12岁年龄段高,但差异无统计学意义[55.04(46.86,98.57)μg·h/mL比47.55(40.11,49.95)μg·h/mL,P=0.065]。A、C组两年龄段MPA血药浓度及MPA-AUC比较,差异均无统计学意义(均为P>0.05)。B组≤12岁年龄段MPA-C4h较A组和C组≤12岁年龄段高,但组间比较差异无统计学意义(表2,P=0.080)。

(二)术后并发症发生情况
随访期间所有受者和移植肾均存活,A组和B组分别在术后5个月和3个月发现1例临床诊断的急性排斥反应,均发生在>12岁年龄段,表现为血清肌酐、血尿素氮、胱抑素C等指标上升,移植肾彩色多普勒超声提示动脉流速增快,阻力指数增高,病理活组织检查提示急性T细胞介导的排斥反应,给予甲泼尼龙冲击后逆转。3组急性排斥反应发生率比较,差异无统计学意义(P>0.05)。
A组6例发生感染,包括肺部感染4例,尿路感染2例,≤12岁和>12岁年龄段各3例;B组4例发生感染,包括肺部感染3例,尿路感染1例,其中3例发生在≤12岁年龄段;C组≤12岁年龄段发生1例肺部感染,3组感染发生率比较,差异无统计学意义(P>0.05)。肺部感染者表现为发热,白细胞计数增加及中性粒细胞比例升高,最终经肺部CT确诊,尿路感染者除了血常规还通过尿培养确诊。感染住院者通过判断感染程度暂时减药或停药,加强抗生素应用均治愈出院,后继续规律服用免疫抑制剂。
三、讨论
肾移植是目前终末期肾病的最佳治疗手段,能极大地改善患者生活质量,而免疫抑制剂的应用是肾移植术后治疗中相当重要的一部分。本研究通过比较不同年龄段的MPA血药浓度,发现EC-MPS在不同年龄段的儿童肾移植受者中的暴露差异。
MMF口服经胃肠道迅速吸收并被酯酶水解成活性形式MPA,生物利用度>90%,达峰时间1~2h;EC-MPS为MPA的肠溶制剂,主要在肠道延迟吸收,达峰时间较MMF有所延迟,通过可逆、非竞争性地抑制次黄嘌呤单核苷酸脱氢酶的活性,抑制T、B细胞中嘌呤的合成来抑制淋巴细胞增殖,从而发挥免疫抑制作用。两种剂型药物也表现出不同的药代动力学特征,在同等生物效应剂量下EC-MPS较MMF有更高的血药浓度。MPA的治疗窗很窄,且个体间差异较大,即使在服药剂量相同的患者中,MPA暴露的差异也有10倍,因此更加需要治疗药物监测(TDM)的管理。目前普遍认为MPA-AUC是观察暴露水平良好的参数,与抗排斥反应效果和药物不良反应显著相关。据多个移植中心的研究报道,MPA的最适剂量是将MPA-AUC控制在30~60μg·h/mL。
儿童群体的变异度极大,随着生长和器官系统的成熟,生理功能的变化将导致其药代动力学发生改变。儿童肾移植术后,受者对MPA的反应随年龄增长而变化,有研究证明MPA的清除与年龄相关。大多数代谢酶都随着儿童年龄的增长逐渐完善,关键药物代谢酶尿苷二磷酸葡萄糖醛酸基转移酶(UGT)亚型(UGT1A9、UGTB27、UGT1A6)完善过程缓慢,其基因表达产物是负责MPA代谢最主要的酶或转运蛋白,通常在10岁左右达到成人水平,因此也造成了MPA代谢差异。Johnson等研究发现细胞色素P450(CYP)34A的表达与活性随年龄增长而显著增加。Krall等发现CYP3A5和UGT1A9基因分型对免疫抑制剂给药和检测有益。儿童胃液pH值、胃排空速率、体脂率、肝脏代谢能力、血浆白蛋白结合能力和年龄依赖的关键代谢酶与成人都存在差异,其药物平均AUC高于成人,这也从侧面证明了在儿童发育阶段随着年龄增长,MPA的暴露可能会逐渐降低。由于儿童药物的吸收、分布、代谢和排泄发生改变,导致在没有药代动力学和药效学研究的情况下,估计正确剂量变得更加困难。然而,目前各中心对MPA TDM还在进一步探索,尚有待完善和统一,关于儿童肾移植药物浓度监测的数据则更加缺乏。随着儿童肾移植的不断发展,MPA浓度的监测与统计研究,制定完善的个体化治疗方案是非常必要的。
本研究结果显示,≤12岁年龄段的儿童MPA-AUC以及MPA-C4h较>12岁年龄段儿童高,这可能是因为青春期是儿童生长发育的强势期,身体的发育较快,药物的暴露率可能也会随之下降。有研究证明,MMF剂量与MPA暴露之间是非线性的,MPA暴露并不随着MMF剂量增加而按比例增加。在半年的随访时间内,A组和B组各有1例经活组织检查证实的排斥反应,均发生在>12岁年龄段,可能证明了这个结果。然而,值得注意的是,不同年龄段MPA浓度的差异主要在服用EC-MPS受者中存在,而未在服用MMF的受者中观察到这种现象。但本研究样本量较少且为单中心研究,具体机制还有待进一步研究。与排斥反应相对应的是感染,本研究4例服用EC-MPS的儿童受者发生感染,其中3例年龄≤12岁,综合结果来看,EC-MPS在≤12岁年龄段的暴露率比>12岁年龄段高,因而受者也更易发生感染。有研究表明儿童在接受治疗剂量的MPA时,可能很长一段时间血药浓度超过治疗水平,导致感染的风险增加。这也是缺乏药代动力学的规律监测导致的。TDM能有效保证疗效与减少毒性,特别是在儿童肾移植中,儿童TDM还需考虑生长发育过程中生理和生化参数,避免受者发生排斥反应和免疫过度。Berger等通过运用TDM调整儿童肾移植术后MMF剂量,以预防暴露量过高或过低导致的不良事件发生。目前有限样本策略(LSS)可根据少数时间点血样本进行估算MPA-AUC,是较符合临床的监测MPA浓度的方法之一。我中心虽然也复查MPA血药浓度,但并不规律,不利于分析儿童肾移植术后长期药物效果。
综上所述,在儿童肾移植中,随着年龄的增长,MPA的暴露率会随之变化,且不同剂型的MPA代谢不同。本研究发现EC-MPS在儿童期暴露较青春期高,也具有相应的排斥反应和感染趋势。未来我们将对儿童肾移植受者进行药物监测,制定改善、合理化个体用药方案,完善儿童肾移植管理方案,提高儿童肾移植质量。
本文仅供学习参考,完整准确内容请查阅原始文献:张杰,成富民,朱昆仑,等.不同霉酚酸剂型在儿童肾移植不同年龄段的暴露差异[J].器官移植,2022,13(3): 356-362. doi: 10.3969/j.issn.1674-7445.2022.03.012
【链接】
儿童肾移植受者的免疫抑制管理
https://bbs.yizhiwang.org.cn/forum.php?mod=viewthread&tid=88376
霉酚酸类药物在器官移植受者中的药代动力学研究进展
https://bbs.yizhiwang.org.cn/forum.php?mod=viewthread&tid=87380
|
|