本帖最后由 灿烂夏花 于 2023-8-29 17:34 编辑
本文作者:云也
患者 30 岁,产后 2 周突发冠状动脉夹层,引起广泛的不可逆性心脏损伤:情况危急,尽快进行心脏移植才能保命。
然而,完成移植前评估后,医生却提出了一个惊人的方案:必须先把原本健康的肝换掉。
明明坏的是心,为什么要把她的好肝换了?
急需移植心脏,但要先把好肝换了
华盛顿大学医学院心脏研究所近期在国际心肺移植学会官方出版物《心肺移植杂志》,报告了这个历史性的双器官移植案例 [1,2]。
2022 年 12 月 7 日,安娜于产后 2 周突发冠状动脉夹层,在其生产的医疗中心使用主动脉内球囊反搏支持,辅以止痛药和升压药,随后转至华盛顿医学院心脏研究所。
孕期的激素水平和血压变化,让冠状动脉更容易发生撕裂,如解剖愈合、无明显心脏损伤时,患者甚至可以带药回家。但安娜很快发生了危及生命的心衰。
由于出现了尖下动脉瘤及 1.0 x 1.6cm 的附壁血栓,团队决定拔除球囊泵,采取左心房至股动脉旁路系统(TandemHeart),通过将含氧血液直接从左心房运送至体循环,降低心脏前负荷和心脏做功,维持有效循环血容量和血压,保证重要组织器官灌注和功能。 12 月 14 日,由于左心房流入套管与左心房紧邻,心房壁穿孔风险大,TandemHeart 又被替换为静脉-动脉体外膜肺氧合(VA-ECMO)系统。
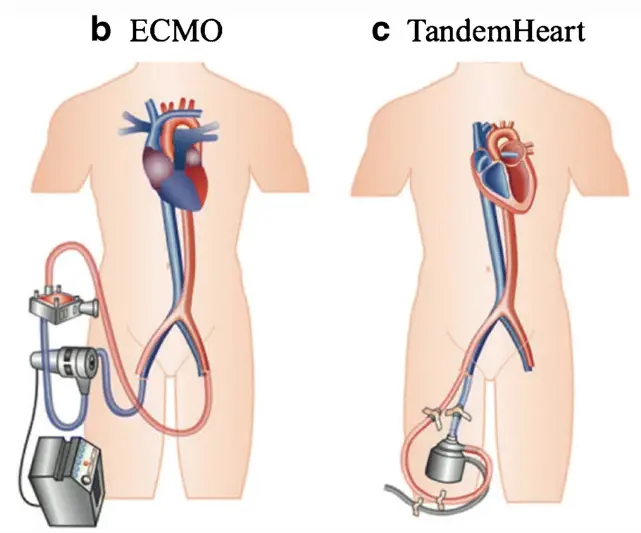
两种体外循环对比示意图 图源:文献 3
在 ECMO 的支持下患者心肺负担暂时减轻,有利于恢复体力、避免额外手术。为了解心脏恢复情况,半个月内医生多次间断尝试中断 ECMO,但每次患者均出现血压骤降,心脏移植成为唯一选择。
2023 年 1 月 5 日,安娜被正式列入心脏移植名单。
每次移植都需检测潜在受体的抗体,以衡量供体器官排斥的可能性。很不幸,抗体检查显示,安娜对移植器官发生排异的概率,几近 100%!

抗体检查结果 图源:文献 1
「孕产妇更有可能处于高敏状态,因为怀孕期间会产生针对父系抗原的抗体。」团队的心衰疾病专家林欣(Shin Lin)介绍,「这些抗体不会攻击胎儿,但会攻击移植的器官,有时仅仅在几分钟内就会发生严重排异。」
通常,因供体没能到位或其他原因暂时无法移植的患者,会选择在长期机械循环支持下等待时机。但安娜左室舒张功能不全,已不足以容纳左心室辅助装置(LVAD)。而且,植入 LVAD 或全人工心脏(TAH),很可能会加剧高敏状态,无异于自绝后路。
更无奈的是,因为病情过于严重,脱敏治疗已不适用:2021 年美、法、日三国合作的前瞻性单臂试验提出的,高敏患者可在心脏移植前,预防性使用补体抑制剂依库珠单抗(Eculizumab)的方案,纳入的 16 例患者供体特异性抗体(DSA)的中位荧光强度(MFI)为 6250,而对于安娜,这一数值早已破万 [4]。
至此,事情又回到原点——移植心脏才能救命,但直接移植几乎注定会因严重排异而失败。
在困境中,林欣向团队提出了一个大胆的想法:先给她换个肝。
「预防性」移植,换下的好肝怎么办?
这并非科学狂想,而是来源于 2021 年 3 月《美国心脏病学会杂志(JACC)》梅奥诊所发表的一项仅纳入 7 名患者的观察性队列研究 [5,6]。
通常,心肝移植的标准程序是「先心后肝」,因为心、肝同时衰竭需要移植时,先解决心脏问题,可以避免循环系统受损。
需要心、肝双器官移植的常见原因是先天性心脏病导致肝硬化性肝病。「因为同时存在心、肝脏问题,患者一般在双器官移植前已有过多次手术和输血。」论文作者、梅奥心血管病专家 Sudhir S. Kushwaha 指出,这些患者常常面临高敏状态所致的「供体库」极度缩小的问题。
根据器官移植经验,移植肝脏有所谓的「免疫特惠」现象,即接受肝移植的患者,通常有较低的排异率——高度血管化的肝脏,就好像一个海绵一样,能够吸收抗体。
既往还有联合器官移植研究报告,在心脏移植进行之前,原位存在先置供体肝脏,可以增强早期免疫学获益,推测机制可能与同种异体移植物中,同种异体免疫介导的损伤减少有关。
于是在此基础上,梅奥团队在这 7 例患者身上尝试逆序心肝移植,即「先肝后心」。
逆序移植研究概况 图源:文献 5
7 名患者均有心、肝双重移植需求,均有不同病因的心力衰竭,肝脏组织学评估证实,6 例伴肝硬化,1 例为非酒精性脂肪性肝炎。其中 1 名患者患有肝细胞癌 ,并最终死于其复发转移。
免疫相容性检测提示:前瞻性流式细胞术 B 细胞和 T 细胞交叉配型 (ProFXM)均为阳性;平均计算组合反应抗体(cPRA)为 75%;DSA MFI 均大于 4,000 的阈值。以上结果均提示他们有更高的排异风险、配型难度极高需要漫长的等待时间。
在标准诱导免疫抑制方案配合下,移植均获成功,未出现心脏同种异体移植物的超急性排异反应,术后没有持续的移植功能障碍,回顾性交叉配型(B 细胞和 T 细胞,ProFXM)全部变为阴性,DSA MFI 水平明显降低(均 < 2000)。
在中位 4 年(25~68 个月)随访中,没有患者出现 > 1R 级以上的排异反应。1 例因转移性癌症死亡,无明显移植物功能障碍。团队认为,肝后心脏移植(heart-after-liver transplant,HALT)这一创新术式,可以推广到许多高敏患者中。
有梅奥团队研究在先,尽管数据池很小,而且与他们同时需要心、肝移植不同,安娜的肝脏是完好的,但林欣仍然认为,HALT「是她生存的最佳机会」。
Kushwaha 曾在梅奥的 2021 年的报道中提出,他们也在探索需要心脏移植,但没有肝硬化的患者的移植可能性,即患者并没有肝脏移植的指征,而以「诱导免疫耐受」为唯一需求进行肝脏移植。
「但根据移植的原则,如果患者不需要肝移植,医生就不能为此让一个供体肝脏脱离循环。」
梅奥团队曾设想了两种可能的解决方案:
其一为节段移植。从供体中取出一段肝脏,供体肝脏将再生;手术分离受体肝脏为供体腾出空间,移植后供体即可提供安全移植心脏所需的抗体吸收作用。
另一种便是「多米诺移植」。取出高敏患者身上健康的肝脏,捐赠给另一名需要移植肝脏的患者,然后高敏患者再接受肝后心脏移植。
林欣计划采用的,便是后者:HALT 变成 HALT-D,意为像多米诺骨牌一样,安娜换下的健康肝脏,将同时移植到另一个需要该器官的患者身上。
团队心脏外科专家 Jay Pal 表示,同事们最初并不同意这样的冒险,但林欣最终还是说服了大家:「我们担心这是复杂患者未经证实的治疗方法。但是确实已经没有其他办法,能让这位年轻的母亲脱离 ECMO 出院。」
6 个月后恢复良好,医生:这不是终极方案
1 月 14 日,器官采购机构通知救治团队,有已故捐赠者提供了两个器官。
待移植的供体心脏 图源:华盛顿大学医学院心脏研究所
基于 2021 年梅奥团队的研究成果,救治团队认为此次的 HALT-D 方案为创新诊疗,而不是研究,在患方知情同意后随即施行。
两名肝脏外科专家首先取出安娜的肝脏,将其置于冰上,并进行肝脏移植手术;两位心脏外科专家随后移植了供体心脏。而相邻手术室里,另一场将安娜的肝脏移植给另一位患者的移植手术同步完成。
手术本身十分顺利,重点在于术后的排异反应,团队逐日监测抗体,直到移植后 65 天,患者对供体器官的抗体才完全消失,cPRA 降为 82%。
减少的抗体仅针对供体 HLAs 和其他具有相关表位的抗原,表明肝脏在她的免疫谱中起主要作用。林欣表示:「这验证了供肝会赋予供心免疫保护,不过目前只是观察到的临床现象,原因仍未找到。」

移植前后抗体情况对比 图源:文献 1
美国心脏协会(AHA)8 月 15 日刚刚发表了双器官移植专家声明。1989~2021 年共计 449 例心肝联合移植中,仅有 7 例为 HALT(即第二部分详述的梅奥研究),成功利用了供体肝脏的免疫保护。
但该观察性研究没有对照组,其中 5 例患者还接受了依库珠单抗的强化免疫抑制,声明也并未基于此作出推荐。[7]

共识提出的心肝联合移植规范 图源:文献 7
目前,评估是否进行心肝联合移植,通常关注晚期心衰患者的肝功能是否可能随着心脏功能的优化而逆转,或者是否进展到足以影响围手术期风险。所以「预防性」地移植肝脏,并无规则可依,在伦理上也存在争议。
上下滑动查看相关伦理意见
器官采购和移植网络 / 联合国系统伦理委员会(OPTN/UNOS Ethics Committee)曾发布《多器官移植的伦理意义》一文,对多器官移植(MOT)提出了伦理问题的解决意见 [8]。
尽管「救命」(即医疗紧急性)一词是 MOT 器官分配伦理分析的关键,但如何定义「救命」一词具有挑战性——所有器官移植,都有潜力挽救受者生命。
OPTN 建议将心脏、肺和肝脏等「可以立即挽救生命的器官」,与肾脏等其他在移植时能够「增强生命但可能在未来挽救生命的脏器」区分开来。

MOT 审查中的器官分类原则
根据效用原则,OPTN 应通过「是否最大限度地提高了潜在器官接受者群体的利益」,来审查任何多器官分配政策,维度包括:
a)医疗效益(例如寿命、医疗紧急性); b)效益质量(QALYs); c)避免无效移植。 根据公平原则,OPTN 审查维度包括: a)机会平等; b)政策影响; c)「公平赛局论(fair innings)」,即优先年龄较小的患者; d) 濒临死亡或遵从「救援规则」;
肝脏与心脏均属于「可以立即挽救生命的器官」。HALT 之所以需要创新为 HALT-D,将取下的健康肝脏移植给下一个患者,就是为了「还给」移植池一个健康的肝脏,尽最大可能避免对效用和公平原则的损害。
救治团队在论文中写道:「病例证明将肝脏作为只需要心脏移植高敏患者的『免疫库』,可以极大地扩大供体库、减少等待时间、挽救生命。HALT-D 方案中的多米诺移植,确保了谨慎管理器官的原则得到维护。」
6 个月后,恢复正常生活的安娜向救治团队表示感谢:「感谢医生就如何挽救我的生命进行的头脑风暴,感谢护理人员的照顾,以及每个在我不知道的地方为拯救我而努力的人。」

移植后 6 个月林欣为安娜听诊
图源:华盛顿大学医学院心脏研究所
但即便成功令人欣喜,团队心衰专家 Daniel Fishbein 仍然认为,用一个器官去抗排异,不应是终极方案。
「我们远未了解移植免疫学的原理,从这样的病人身上我们应当学到很多。我们需要探究现象背后的本质,有朝一日,可以用药物解决问题,而不是用一个个器官来重复这次的成功。」
致谢:本文经 西安交通大学第一附属医院心外科主任 闫炀、北京大学第一医院心内科主治医师 鲍明慧、中国医学科学院阜外医院心外科住院医师 李昊桐 专业审核
【注】
西安交通大学第一附属医院心外科主任 闫炀 审核意见:
华盛顿大学医学院的这一案例,主要有两点突破:一是患者的肝脏是健康的,接受肝脏移植的目标只是为了解决高敏状态下对供心的排异;二是器官接受者自己的健康肝脏,被移植给了第二名患有晚期肝病的患者。
肝脏是免疫特惠器官,临床肝移植术后排斥反应的发生率及程度远较其他实质脏器移植低,然而,迄今为止,尚没有一种理论能够完美地解释肝免疫特惠现象。
移植免疫学家提出许多关于肝移植天然免疫耐受的机制和假说,如可溶性 MHC-Ⅰ 类抗原、肝内大量血窦内皮结构及丰富的免疫细胞群、供者微嵌合体形成、调节性 T 细胞、同种反应性 T 细胞在肝原位凋亡等。
因此,依靠肝脏移植降低和清除 DSA 受者抗体,达到减低后续心脏移植抗体介导排异反应的作用具有一定风险性,具体作用机制尚不十分清晰。
从伦理角度,将高敏患者肝脏移植给普通受者,仍存在一定术后抗体介导排异或是胆道并发症的风险、具有一定伦理学问题,且术前应进行抗体清除或吸附等预防治疗措施,临床推广需谨慎实施。
综上所述,本案例作为个例成功,为未来的这类患者的移植提供了新的思路,但应进一步完善免疫机制研究,才宜在临床进一步应用。
文中安娜为化名
策划:云也 | 监制:gyouza、carollero
原文链接 https://health.ifeng.com/c/8ScCG6W9j0a
|